Asit Baz Dengesi Nedir, Nasıl Sağlanır? pH, Tampon Sistemleri, Akciğer ve Böbreğin Rolü
- Giriş
- Vücutta Günlük Üretilen Asitler, Kaynakları, Miktarları ve Atılım Mekanizmaları
- Nedir Bu pH?
- Konunun Anlaşılmasındaki Zorluklar
- Karbondioksit (CO₂) Vücutta Nasıl Oluşur, Kanda Nasıl Taşınır, Akciğerlerden Nasıl Atılır, Ne İşe Yarar?
- Asit Baz Dengesinin Regülasyonu / Vücuttaki Asit - Baz Dengesi Nasıl Korunur?
- Kaynaklar

1. Giriş
Asit-baz dengesi, kan ve diğer vücut sıvılarının optimal pH (asitlik) seviyesinde tutulmasıdır. Asit baz dengesi, kan gazı ölçüm cihazları ile arteriyel kan pH’sı ölçülerek değerlendirilir, normali 7,35-7,45 aralığıdır yani hafif baziktir (alkalidir). pH < 7,35 asidoz, pH > 7,45 alkalozdur.
Optimal pH seviyesi (7.35-7.45), vücuttaki biyokimyasal (metabolik) reaksiyonlar, hücresel fonksiyonlar ve organların (özellikle kalp ve damar sistemi) düzgün çalışması için gereklidir.
2. Vücutta Günlük Üretilen Asitler, Kaynakları, Miktarları ve Atılım Mekanizmaları
Vücut her gün metabolik süreçlerden kaynaklanan büyük miktarda asit üretir. Akciğerler, böbrekler ve tampon sistemler bu asitlerin dengelenmesi ve atılmasında birlikte çalışır.
Akciğerler uçucu asitlerin (volatile) , böbrekler ise uçucu olmayan (nonvolatile) asitlerin atılmasında ana role sahiptir.
Volatil asitler, vücutta metabolik süreçler sonucunda oluşan ve karbondioksite (CO2) dönüşerek akciğerler yoluyla atılabilen asitlerdir. Karbonhidrat ve yağların metabolizması sırasında yaklaşık 15.000 mmol CO2 üretilir
Non-volatil asitler, karbondioksite dönüşemezler ve böbrekler aracılığıyla atılırlar. Bu asitler, amino asitler, nükleoproteinler, fosfolipidler ve fosfoproteinlerin yıkılmasıyla oluşur ve günlük yaklaşık 50-100 mEq non-volatil asit üretilir.
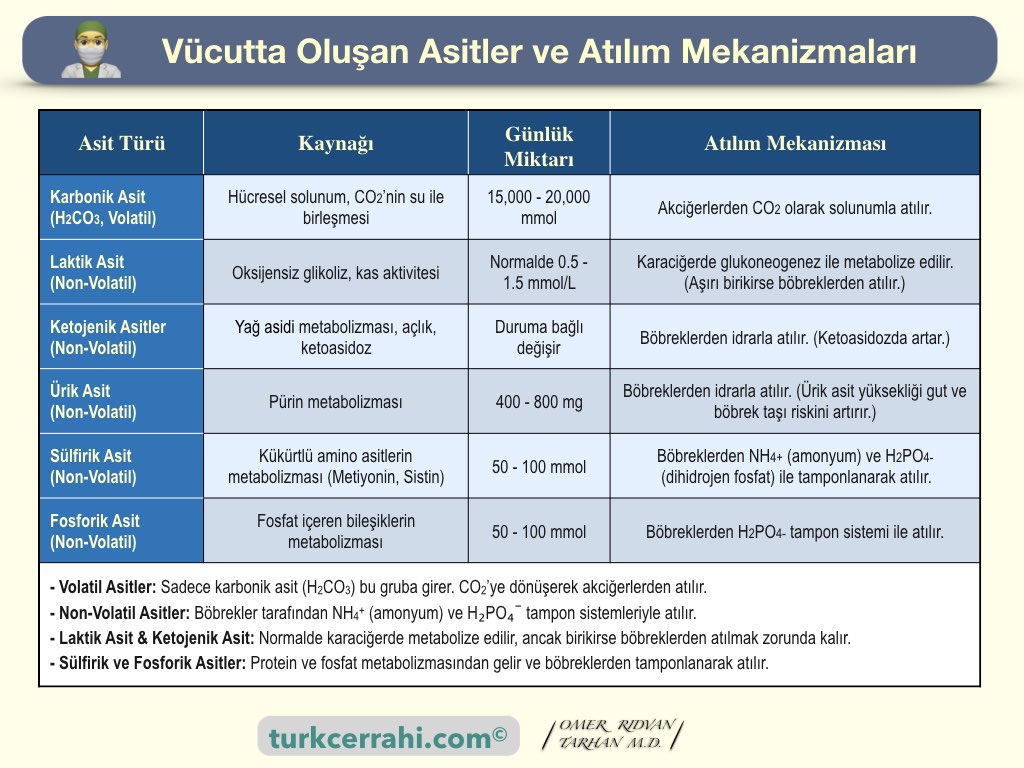
| Asit Türü | Kaynağı | Günlük Miktarı | Atılım Mekanizması |
|---|---|---|---|
| Karbonik Asit (H2CO3, Volatil) | Hücresel solunum, CO2’nin su ile birleşmesi | 15,000 - 20,000 mmol | Akciğerlerden CO2 olarak solunumla atılır. |
| Laktik Asit (Non-Volatil) |
Oksijensiz glikoliz, kas aktivitesi | Normalde 0.5 - 1.5 mmol/L | Karaciğerde glukoneogenez ile metabolize edilir. (Aşırı birikirse böbreklerden atılır.) |
| Ketojenik Asitler
(Non-Volatil) |
Yağ asidi metabolizması, açlık, ketoasidoz | Duruma bağlı değişir | Böbreklerden idrarla atılır. (Ketoasidozda artar.) |
| Ürik Asit
(Non-Volatil) |
Pürin metabolizması | 400 - 800 mg | Böbreklerden idrarla atılır. (Ürik asit yüksekliği gut ve böbrek taşı riskini artırır.) |
| Sülfirik Asit (Non-Volatil) |
Kükürtlü amino asitlerin metabolizması (Metiyonin, Sistin) | 50 - 100 mmol | Böbreklerden NH4+ (amonyum) ve H2PO4- (dihidrojen fosfat) ile tamponlanarak atılır. |
| Fosforik Asit | Fosfat içeren bileşiklerin metabolizması | 50 - 100 mmol | Böbreklerden H2PO4- tampon sistemi ile atılır. |
| - Volatil Asitler: Sadece karbonik asit (H2CO3) bu gruba girer. CO2’ye dönüşerek akciğerlerden atılır. - Non-Volatil Asitler: Böbrekler tarafından NH4+ (amonyum) ve H₂PO₄⁻ tampon sistemleriyle atılır. - Laktik Asit & Ketojenik Asit: Normalde karaciğerde metabolize edilir, ancak birikirse böbreklerden atılmak zorunda kalır (örn. laktik asidoz, ketoasidoz). - Sülfirik ve Fosforik Asitler: Protein ve fosfat metabolizmasından gelir ve böbreklerden tamponlanarak atılır. |
|||
Asitlerin Atılım Mekanizmaları:
- Akciğerler: Karbondioksiti solunum yoluyla atar.
- Böbrekler:
- Hidrojen iyonlarını idrarla atar.
- Bikarbonat iyonlarını geri kazanır.
- NH4+ ve H₂PO₄⁻ tamponları kullanır.
- Karaciğer: Laktik asit ve keton cisimlerini metabolize eder.
- Cilt (Terleme): Az miktarda organik asit atılımına katkı sağlar.
3. Nedir Bu pH?
pH, bir çözeltideki hidrojen iyon konsantrasyonunu gösteren bir ölçü birimidir. Diğer bir deyişle pH; çözeltinin, asidik, bazik veya nötr olduğunu belirten bir ölçüdür.
1909'da Danimarkalı kimyager Søren Peder Lauritz Sørensen, asitliği ifade etmenin bir yolu olarak pH kavramını tanımlamıştır. pH’nın, Danca “Potens” ve “Hydrogen” kelimelerinden türetildiği rivayet edilir (Potens= İngilizce “potency”, Türkçe “potansiyel - güç”). pH’yı Türkçeye çevirirsek “potansiyel Hidrojen” olarak ifade edebiliriz.
pH, bir çözeltideki hidrojen iyon konsantrasyonunun ([H+], mol/litre) negatif logaritması dır, ya da başka bir deyişle 1/ logaritmasıdır (matematikten hatırlayın!). Daha anlaşılabilir olması için söylediklerimizi formül şeklinde yazalım.
- pH= - log [ H+] = 1 / log [ H+]
Logaritma bahsini hatırlıyorsanız, bu formüle göre pH arttıkça hidrojen iyon konsantrasyonu azalmakta, pH azaldıkça hidrojen iyon konsantrasyonu artmaktadır. Başka bir deyişle pH değeri ile sıvının asitliği ters orantılıdır.
- pH ölçeği 0 ile 14 arasındadır.
- pH 7, nötr çözeltidir (örneğin, saf su).
- pH < 7, asidik çözeltidir pH > 7, bazik (alkali) çözeltidir
4. Konunun Anlaşılmasındaki Zorluklar
- Solunumun temel mekanizmasını, eritrosit, karbondioksit, karbonik asit, bikarbonat ve karbonik anhidraz ilişkilerini bilmemek.
- Kimyasal tampon sistemlerinin ve Henderson Hasselbalch eşitliğinin tam anlaşılamaması (bu konudaki kimya bilgimizi tazelemeliyiz).
- Asit baz bozukluklarının yanlış sınıflandırılması. Mesela asit baz bozuklukları ikiye ayrılıyor; asidozlar, alkalozlar sonra bunlarda ikiye ayrılıyor metabolik asidoz, solunumsal asidoz, metabolik alkaloz solunumsal alkaloz. Bize göre bu şekilde bir sınıflama yerine asit baz bozukluklarının baştan 4 e ayrılması ve hepsinin teker teker öğrenilmeye çalışılması gerekir. Her ikisi de asidoz olmasına rağmen, metabolik asidozla, solunumsal asidozun hem etyolojileri hem de tedavileri tamamen birbirinden farklıdır.
- Birden fazla sınıflandırmanın olması. Özellikle metabolik asidozda, hem etyolojik sınıflama (artmış asit üretimi, infüzyonu, artmış bikarbonat kaybı) hem de normal anyon gaplı ve artmış anyon gap’lı sınıflamalar.
- Asit baz dengesi bozukluğuna tek bir faktörün neden olduğu zannı. Özellikle klinik hastalıklarda birçok faktör asit baz dengesini bozar, örneğin travma, septik ya da hemorajik şok gibi klinik durumlarda metabolik asidozun yanı sıra (iskemi), sıvı ve elektrolit dengesizlikleri, özellikle şoku kompanse etmesi gereken akciğer ve böbrek yetmezlikleri tabloyu iyice karmaşıklaştırır.
5. Karbondioksit (CO₂) Vücutta Nasıl Oluşur, Kanda Nasıl Taşınır, Akciğerlerden Nasıl Atılır, Ne İşe Yarar?
Karbondioksit ve oksijen gibi gazlar difüzyon yoluyla hücre zarından geçebilir. Difüzyon, gaz moleküllerinin yarı geçirgen bir zar yoluyla daha yüksek konsantrasyonlu bir bölgeden daha düşük konsantrasyonlu bir bölgeye hareketidir.
Yani, karbondioksit ve oksijenin hücre - plazma - eritrosit - alveol arası geçişleri difüzyon yoluyla olur. Ama bu karbondioksit ve oksijenin tamamının, kanda erimiş olarak taşındığı anlamına gelmez. Aşağıda karbondioksit ve oksijenin kanda nasıl taşındığı ayrıntılı açıklanmaktadır.
Kandaki asit baz dengesinin sürdürülmesinde aşağıdakilerin birbirleriyle yakın bağlantısı bulunur
- Hücresel solunum (aerobik - anaerobik) ve oluşan karbondioksit
- Karbondioksitin kanda taşınması ve akciğerlerden atılması
- Akciğer solunumu (ventilasyon)
ATP hücresel işlemlerde kullanılan bir enerji kaynağıdır. Hücrelerimiz karbonhidrat ve yağları yakarak ATP üretmek için oksijen kullanır, bu sırada karbondioksit oluşur. Karbondioksit hücrelerde oluşan bir çöptür ve vücuttan atılmalıdır. Nefes alırken akciğerlerimizde oksijen alırız karbondioksit atarız.
Her ne kadar karbondioksit oksijenli hücresel solunum neticesi oluşan bir çöp ise de, karbondioksit aynı zamanda kan pH’sının sabit tutulmasında en önemli bileşendir.
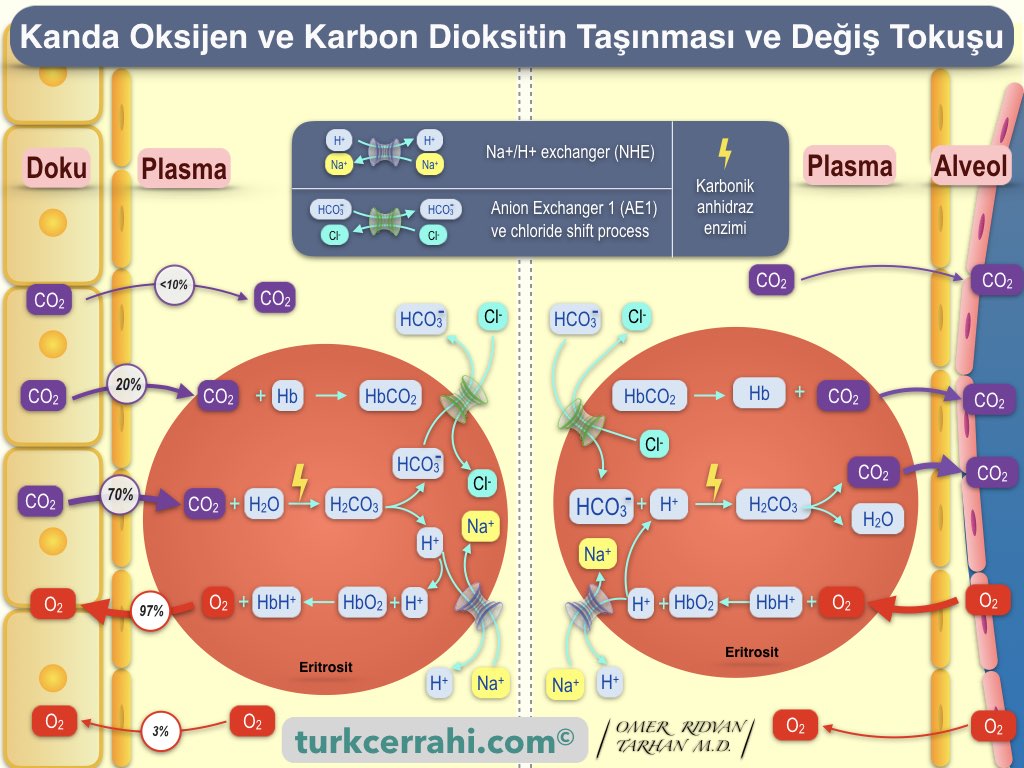
Kanda Karbondioksit 3 Şekilde Taşınır (Bulunur):
- Kan plazmasında (kanda) çözünmüş halde (< %10)
- Hemoglobin ile (% 20)
- Karbonik asit şeklinde ve bikarbonat şeklinde taşınır (% 70).
Soluduğumuz havanın içindeki oksijen ile karbonhidrat ve yağlar yıkılır (yakılır) ve enerji elde edilir (glikoliz ve Krebs siklusu). Oksijen kanımıza akciğerlerden girer, kanda hemoglobin ile taşınır (eritrosit). Hücrelerdeki karbonhidrat ve yağın yakılması ile de yan ürün olarak karbondioksit (CO2) oluşur ve vücuttan atılmalıdır.
Karbondioksit kanla akciğere taşınır (kanda çözünmüş olarak <%10 (∼%7), hemoglobine bağlanarak ∼%20, bikarbonat ∼%70).
CO₂'nin Çözünmüş Halde Taşınması
CO2'nin küçük bir kısmı çözünmüş halde akciğerlere taşınır. Bu, normalde taşınan tüm CO2'nin yaklaşık %7'sidir.
CO₂'nin Hemoglobin (Karbaminohemoglobin) ve Plazma Proteinleri ile Taşınması
Karbondioksitin %20 kadarını hemoglobin taşır. Her bir hemoglobin, 4 molekül CO2'yi tutabilir. Hemoglobin CO2'ye bağlandığında buna karbaminohemoglobin denir. Karbondioksit, hemoglobin molekülünün şeklini bir miktar değiştirir, hemoglobinin oksijene olan ilgisini azaltır (Bohr Etkisi). Böylece, CO2’nin yoğun olduğu dokularda, O2'nin hemoglobinden ayrılması kolaylaşır. Böylece, oksijen-hemoglobin disosiasyon eğrisi sağa kayar.
Az miktarda CO2 plazma proteinlerine bağlanarak taşınır.
CO₂’nin Bikarbonat İyonu Şeklinde Taşınması
Karbondioksit difüzyon ile eritrosit içine girer. Eritrositte bulunan karbonik anhidraz enzimi, karbondioksitin (CO2) karbonik asite (H2CO3) dönüşümünü bir milyon kez hızlandırır. Karbonik anhidraz plazmada bulunmaz. Karbonik asit, kararsız bir ara moleküldür, hemen bikarbonat (HCO3-) ve hidrojen (H+) iyonlarına ayrışır.
Yeni sentezlenen bikarbonat iyonu, eritrosit membranındaki “Anion Exchanger 1 (AE1) proteini” sayesinde, bir klorür iyonunun (Cl-) eritrosit içine girmesi karşılığında, eritrosit dışına (plazmaya) çıkar. Bu olaya “chloride shift process” denir.
Oluşan hidrojen iyonunun (H+) ise bir kısmı hemoglobine bağlanır, bir kısmı ise ise “Na+/H+ exchanger (NHE)” sayesinde, sodyum iyonu ile yer değiştirerek eritrosit dışına (plazmaya) geçer.
Kan akciğerlere ulaştığında, klorür iyonu yerine bikarbonat iyonu kırmızı kan hücresine geri taşınır. H+ iyonu hemoglobinden ayrışır ve bikarbonat iyonuna bağlanır böylece karbonik asit ara molekülü oluşur (karbonik anhidraz enziminin katalizörlüğünde). Karbonik asit ise kendiliğinden, karbondioksit ve suya dönüşür. Oluşan karbondioksit ise alveollere oradan da nefes verme sırasında akciğerlerden dışarı atılır.
Karbonik Anhidraz (Karbonat Dehidrataz, Karbonat Hidrolaz, Karbonhidraz)
Çinko içeren bir proteindir. Karbonik anhidraz çok özel bir enzimdir, plazmada serbest olarak bulunmaz; başlıca eritrositlerde, böbrekte, mide mukozasında ve retinada bulunur. Bulunduğu yerde pH ve sıvı dengesini etkiler.
Karbonik anhidraz, mide mukozasında asit salgılanmasında rol oynar, aynı enzim pankreas sıvısının alkali, tükürüğün nötr hale getirilmesini sağlar. Böbrekte, bu enzimin idrar asitleştirmesinde ve bikarbonatın reabsorbsiyonunda çok önemli bir rol oynar.
Oksijen (O₂) Kanda Nasıl Taşınır?
Oksijen difüzyon yoluyla alveollerden plazmaya, oradan da yine difüzyon ile eritrosit membranından geçerek eritrosit için girer. Oksijenin plazmada (kanda) çözünmesi zayıftır. Bu yüzden oksijen, kanda (plazmada) %3 oranında çözünmüş olarak taşınırken, %97 oranında ise hemoglobine bağlı olarak taşınır.
Hemoglobin (Hb) eritrositlerde bulunan, oksijen ve karbondioksitin taşınmasında görev yapan bir proteindir. Dört alt birimden oluşur (iki alfa, iki beta). Her bir alt birimde, bir heme grubu bulunur. Her heme grubunda, içinde demir bulunan bir porfirin halkası bulunur. Bu demir, oksijen moleküllerini bağlamak ve taşımak için kullanılır.
Ayrıca, hemoglobin dokularda oluşan karbondioksitin de yaklaşık %20’sini akciğerlere taşır.
Hemoglobin, vücudun asit-baz dengesinin düzenlenmesinde de önemli bir rol oynar.
Hem gruplarına oksijen bağlı olan hemoglobin molekülleri parlak kırmızıdır. Bu yüzden, hemoglobinin dört oksijen molekülü taşıdığı oksijenli arteriyel kan parlak kırmızı, oksijeni kullanılmış venöz kan ise koyu kırmızıdır.
6. Asit Baz Dengesinin Regülasyonu / Vücuttaki Asit - Baz Dengesi Nasıl Korunur?
Vücut sıvıları ve kandaki asit baz dengesi 3 mekanizmayla korunur
- Kandaki tampon sistemleri (kısa vadede)
- CO2 / HCO3- tampon sistemi (Karbondioksit / bikarbonat, en önemlisi!)
- Eritrosit / Hemoglobin tampon sistemi
- Protein tampon sistemi
- Fosfat tampon sistemi
- Akciğerler (orta vadede, karbondioksiti düzeyini değiştirerek)
- Böbrekler (uzun vadede, Bikarbonat düzeyinin değiştirerek)
Sıvıların asitliği ya da bazlığı pH değeri ile ifade edilir. pH en az “0” (kuvvetli asit) en çok “14” (kuvvetli baz) olabilir. Bu skalanın tam ortası nötral değerdir (pH 7.0). Kan pH sı 7.40 dır yani hafif baziktir (Kan pH Sınır Değerleri= 7.35-7.45).
Metabolik reaksiyonların, dolayısıyla hücre fonksiyonlarının, yani hayatın idamesi için kanda ve dokularda normal pH değerinin idamesi gerekir. Vücutta, asit-baz dengesi, sıvı dengesi ve elektrolit dengesi birbiriyle yakın ilişkilidir. Bu sistemlerden birindeki değişiklik diğerlerini de etkiler.
Her asit baz dengesizliğinde (metabolik asidoz-alkaloz, solunumsal asidoz-alkaloz) kan pH sını normale döndüren yedek (kompansatuar) mekanizmalar vardır. Genel olarak, “solunum sistemi, metabolik bozuklukları telafi eder”; “metabolik mekanizmalar, solunum bozuklukları telafi eder”.
Kimyasal pH Tampon Sistemleri
Konuyu iyi anlamak için bazı kavramları hatırlamamızda yarar var.
Asit ve Baz İle İlgili Tanımlamalar
Kimyasal tampon sistemlerine geçmeden önce bazı tanımlamaları açıklayalım.
Asit: Suya karıştırıldığında, suya hidrojen iyonları (H+) veren kimyasaldır (başka bir deyişle asit; proton verir, elektron alır). Asitlerin hemen hepsinin yapısında hidrojen atomu bulunur.
Örnekler
- (Karbonik asit) H2CO3 → H+ + HCO3-
- (Hidroklorik asit) HCl → H+ + Cl-
Baz: Suya karıştırıldığında, suya hidroksil iyonları (OH-) veren kimyasaldır (başka bir deyişle baz; elektron verir, proton alır).
Örnekler
- (Bikarbonat) HCO3- + H+ → H2CO3
- (Amonyak) NH3 + H2O → NH4+ + OH-
- (Sodyum hidroksit) NaOH → Na+ + OH-
Kuvvetli Asit: Suya döküldüğünde tamamen iyonlarına ayrışan asitlerdir (Örneğin; HCl, hidroklorik asit)
Kuvvetli Baz: Suya döküldüğünde tamamen iyonlarına ayrışan bazlardır (Örneğin; NaOH Sodyum hidroksit, KOH potasyum hidroksit)
Zayıf Asit: Suya döküldüğünde tamamen iyonlarına ayrışmaz. Çözünmeyen asit ile çözünen iyonlar bir denge halindedir.
Zayıf Baz: Suya döküldüğünde tamamen iyonlarına ayrışmaz. Çözünmeyen baz ile çözünen iyonlar bir denge halindedir.
Zayıf asit veya bazın suda çözünmesi ile ilgili tepkimeyi çift yönlü okla gösterirken (çift taraflı tepkime, denge tepkimesi), kuvvetli asit veya bazın suda çözünmesi ile ilgili tepkimeler tek yönlü okla gösterilir.
- HA ⇌H+ + A- (Zayıf Asit)
- HA →H+ + A- (Kuvvetli Asit)
Zayıf Asit ve Bazların Tamponlama Özelliği
Kimyada tampon; asit veya alkali eklendiğinde pH daki değişikliklere dirençli çözelti demektir.
(Diğer adlandırmalar; pH tamponu, hidrojen iyonu tamponu veya tampon çözeltisi)
Kimyasal tampon; zayıf asit ve eşlenik bazı veya zayıf baz ve eşlenik asidinin sulu çözeltisidir. Bu çözeltiler pH değişimlerine dirençlidir.
Canlıda biyokimyasal olaylar dar bir pH aralığında gerçekleşir (insanda 7.35-7.45). pH'ın sabit tutulması tampon sistemleri ile olur. Akciğerler ve böbrekler de kimyasal tamponlama mekanizmasına katkıda bulunarak etki ederler.
Hücre içindeki en önemli tampon sistemi protein ve fosfatlardır. Hemoglobin, eritrositin içinde en önemli tampondur.
Kandaki (ekstrasellüler) en önemli (temel) kimyasal pH tampon sistemi, karbonik asit (erimiş CO2 den oluşur), bikarbonat ikilisidir (HCO3-).
Karbonik Asit - Bikarbonat Tampon Sistemi (H₂CO₃ - HCO₃⁻)
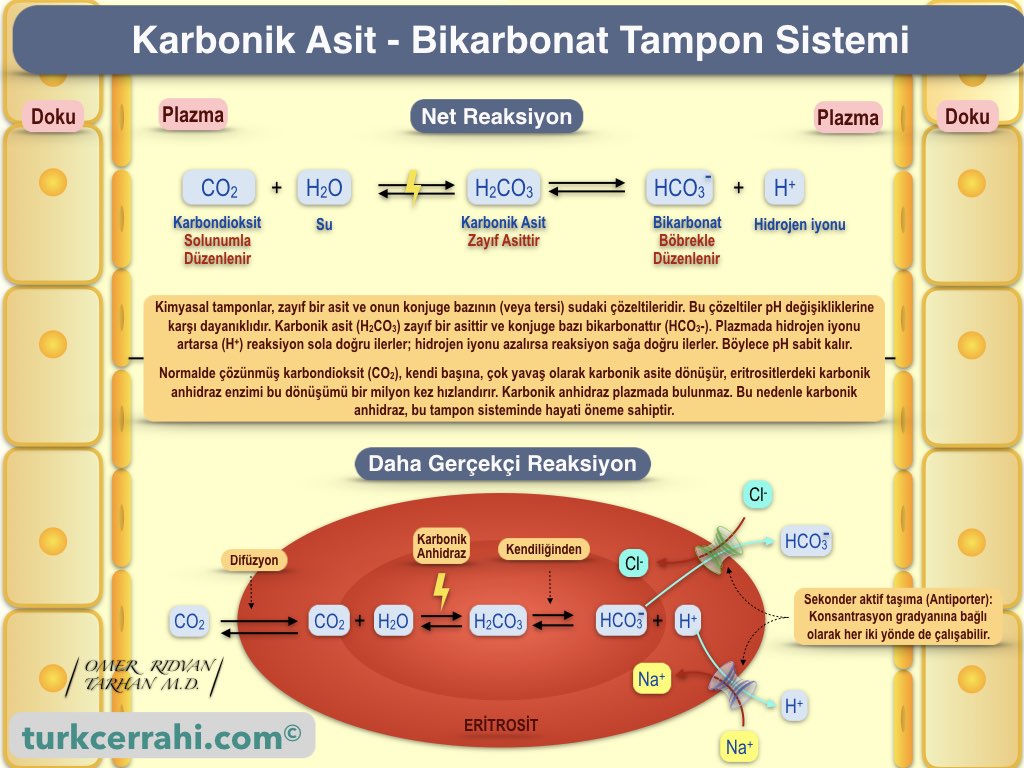
Karbonik asitin (zayıf asittir) bulunduğu bir çözeltiye, baz eklendiğinde, bazdan gelen iyonlar, zayıf asitin hidrojen iyonları ile birleşir ve onları tüketir. Buna karşılık, karbonik asit tekrar aynı dengeyi kurmak için iyonlarına ayrışır (reaksiyon sağa doğru çalışır). Böylece, beklenen pH artışı olmaz . Diğer bir deyişle karbonik asit çözeltisi, ortama eklenen bazı tamponlar.
Karbonik asitin bulunduğu bir çözeltiye, asit eklendiğinde, reaksiyon bu sefer sola doğru çalışır. Böylece beklenen pH düşüşü olmaz.
Fosfat Tampon Sistemi
Fosfat tampon sistemi majör bir hücre dışı (ekstrasellüler) sıvı tamponu olmamasına rağmen, renal tübüler sıvı ve hücre içi (intrasellüler) sıvıların tamponlanmasında önemli bir rol oynar.
Fosfatlar kanda iki biçimde bulunur: Zayıf bir asit olan sodyum dihidrojen fosfat (Na2H2PO4-) ve zayıf bir baz olan sodyum monohidrojen fosfat (Na2HPO4=).
Protein Tampon Sistemi
Proteinler önemli hücre içi tamponlarıdır. Proteinler, pozitif yüklü amino grupları ve negatif yüklü karboksil grupları içeren amino asitlerden oluşur. Bu moleküllerin yüklü bölgeleri hidrojen ve hidroksil iyonlarını bağlayabilir ve dolayısıyla tampon görevi görür.
Vücut sıvılarının toplam kimyasal tamponlamasının yaklaşık %60 ila %70'i hücrelerin içindedir ve bu tamponlamanın çoğu hücre içi proteinlerden kaynaklanır. Ancak hücre içinde proteinlerin yaptığı tamponlamanın etkisinin ekstrasellüler sıvıda görülebilmesi için birkaç saat geçmesi gerekir. Çünkü, hatırlarsanız normalde iyonların hücre zarlarından difüzyonu (H+ ve HCO3- dahil) çok yavaştır ancak eritrositlerin membranında bolca iyon değiştirici proteinler bulunur, bunlar sekonder aktif transport mekanizması ile çalışır (Anion exchanger 1 HCO3- / Cl-) ve NHE (Na+ / H+ exchanger)).
Hemoglobin Tampon Sistemi
- H+ + Hb ⇌ HHB
Hemoglobin, eritrositin içindeki ana proteindir ve ağırlığının üçte birini oluşturur. CO2'nin bikarbonata dönüşümü sırasında açığa çıkan hidrojen iyonları, oksijenini bırakan indirgenen hemoglobin tarafından bağlanır (tamponlanır). Pulmoner kapillerde süreç tersine işler.
Akciğerlerin Rolü
Solunum sistemi (akciğerler), kandaki karbondioksit seviyesini (dolayısıyla karbonik asit seviyesini) düzenleyerek vücuttaki asit ve baz dengesine katkıda bulunur.
Solunum hızı ve derinliği arteriyel ve santral kemoreseptörler (sensörler) sayesinde düzenlenir.
- Aort ve karotis cisimlerinde (body) bulunan “arteriyel kemoreseptörler” CO2 seviyelerinin yükselmesi veya düşmesi durumunda beyne anında sinyal gönderir ve solunum hızında ayarlama yapılır.
- Medulla oblongatada bulunan “santral kemoreseptörler” BOS daki (beyin omurilik sıvısı) pH değişikliğine duyarlıdır. Santral kemoreseptörler, yakınında bulunan solunum merkezini uyararak solunum hızının ayarlanmasını sağlar. Aslında kandaki pH değişikliği direkt olarak BOS’a yansımaz. Kan beyin bariyeri hidrojen iyonlarına karşı geçirgen değildir ancak karbondioksite karşı geçirgendir. BOS daki karbondioksit karbonik asite dönüşür, bu da BOS pH sını düşürür. Yada tersi olur. Bazı kaynaklara göre santral kemoreseptörler hem pH hem de CO2 ye duyarlıdır.
Sonuç olarak solunumun frekansı ve derinliği (tidal volüm) değiştirilerek, karbondioksit akciğerlerden daha az ya da çok atılır. Bu da, kan pH’sını azaltır ya da artırır. Solunumun ayarlanması dakikalar içinde olur.
Böbreklerin Rolü
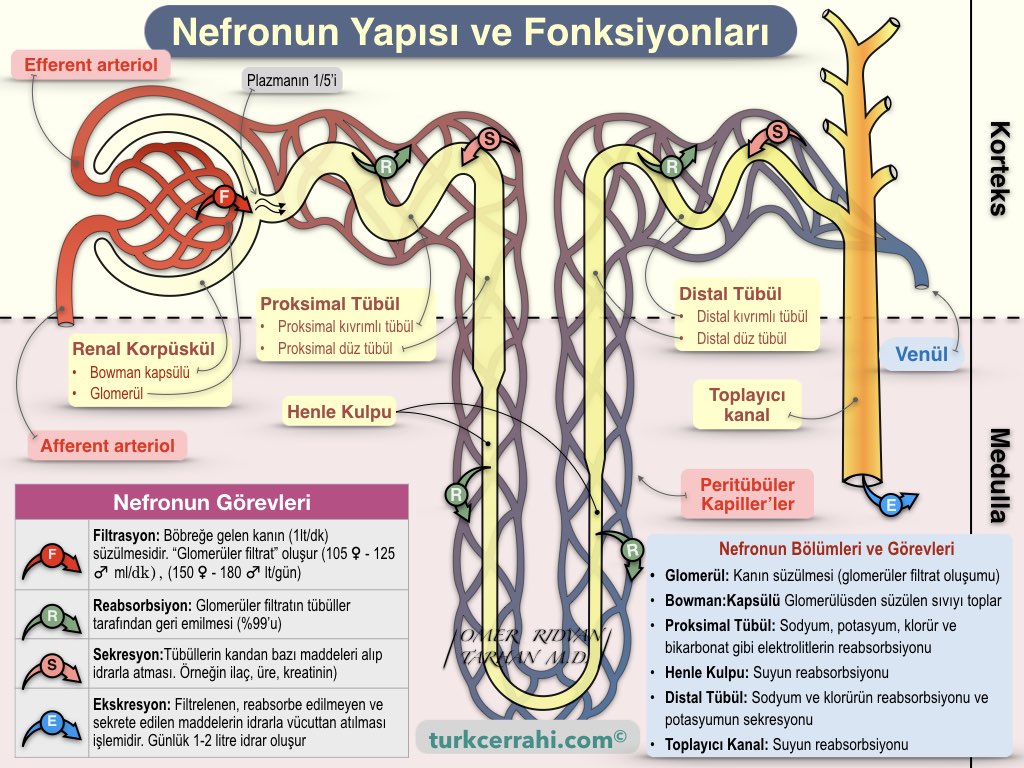
Önce kısaca böbreklerin yapısını ve nasıl çalıştığını hatırlayalım.
Böbreklerin Yapısı ve Fonksiyonu (İdrar Oluşumu)
Böbreklerin temel işlevi idrar oluşturmaktır. Bu sayede vücuttaki fazla su, vücut atıkları ve yabancı kimyasallar (daha alengirli bir deyişle xenobiyotikler) idrarla atılır. Atılacak maddeler iki yolla idrara geçer; filtrasyon (kandan idrara geçer ama geri emilmez) ve sekresyon (kandan idrara salgılanır).
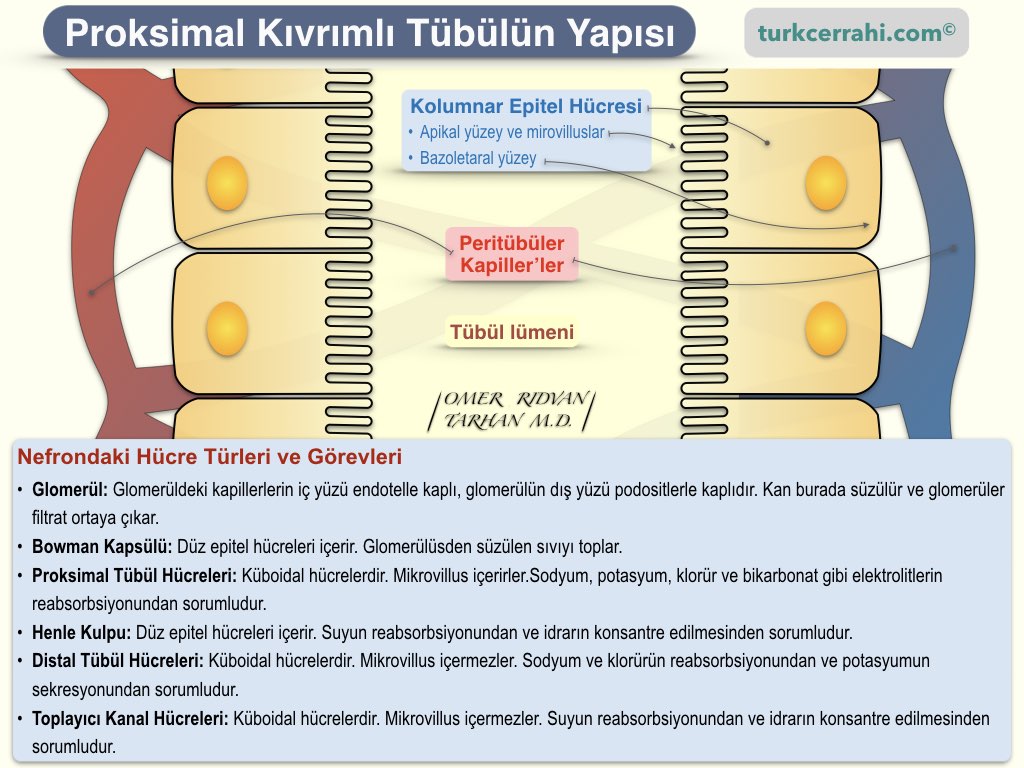
Böbreğin fonksiyonel ünitesi nefrondur, 6 ana bölümden oluşur;
Glomerül ve bowman kapsülü renal korpüskülü oluşturur ve böbreğin korteksinde bulunur (koyu renkli dış kısım). Tübülüsler medullada bulunur (açık renkli iç kısım). Tübüllerin iç yüzeyi küboidal epitel ile kaplıdır. Epitel hücrelerinin lümene bakan yüzü fırça gibidir (mikrovilluslar, apikal yüz-surface). Peritübüler kılcal damarlara bakan diğer düz yüzü ise bazolateral yüzeydir (surface).
Böbreklerin kandaki atık maddeleri ve fazla suyu filtrelemesi başka bir deyişle idrarın oluşumu üç temel mekanizmayla olur:
- Glomerüler Filtrasyon
- Tübüler Reabsorbsiyon
- Sekresyon
Afferent aretriolden gelen kan, glomerül denen kapiller ağdan geçerek efferent arteriole dökülür. Bu bir istisnadır; çünkü kapiller sistemlerde kan venüle dökülür. Efferent arteriolün buradaki rolü, kanın glomerüllerden süzülmesi için gerekli hidrostatik basıncı oluşturmasıdır. Oluşan glomerüler filtrat bowman kapsülüne, oradan da tübüllere geçer.
Tübüllerin çevresinde de kapiller ağlar bulunur. Glomerüler filtrattaki su, glikoz, potasyum ve amino asitlerin neredeyse tamamı böbrek tübüllerinden yeniden kana geçer (tübüler reabsorbsiyon).
Sekresyon, proksimal tübülde gerçekleşir. Bazı moleküller kandan idrara aktif transport (ATP) ya da pasif difüzyonla (maddenin yüksek konsantrasyonlu bölgeden, düşük konsantrasyonlu bölgeye geçmesi) taşınmasıdır.
Sekresyonla idrara geçen önemli moleküller
- Potasyum iyonları (K+)
- Hidrojen iyonları (H+)
- Amonyum iyonları (NH4+)
- Kreatinin
- Üre
- Bazı hormonlar
- Bazı ilaçlar (örneğin penisilin)
Böbrekler Asit Baz Dengesini Nasıl Korur?
Solunum sistemi CO2'nin atılmasını kontrol ederek kandaki karbonik asit seviyelerini (dolayısıyla kan pH’sını) kontrol ederken, böbrekler kandaki bikarbonat (HCO3-) ve hidrojen iyonu (H+) seviyelerini kontrol eder. Biraz daha açalım; böbrekler idrardan, ihtiyaca göre daha az ya da daha çok bikarbonatı kana reabsorbe ederken, kandan idrara hidrojen iyonu salgılar (sekresyon).
İdrarın da olması gereken belli bir pH aralığı vardır. Bu yüzden, sekrete edilen hidrojen iyonları, idrarın amonyak ve fosfat tampon sistemleriyle hem tamponlanır hem de atılır. Böbrekler aracılığıyla sağlanan kan pH değişikliği birkaç gün alır (akciğerlerden daha yavaş).
Yani böbrekler, asit baz dengesinin korunmasını üç yolla sağlar.
- Bikarbonat Reabsorpsiyonu: Proksimal kıvrımlı tübül hücreleri, filtrasyon sırasında glomerüler filtrata geçen bikarbonat iyonlarını (HCO3-) geri emer. Bu, kan pH ının dengelenmesinde önemli bir rol oynar çünkü bikarbonat (HCO3-) , vücuttaki ana asit-baz tampon sistemlerinden biridir.
- Hidrojen İyonlarının Salgılanması: Proksimal, distal kıvrımlı tübül ve toplayıcı kanallardaki (collecting duct) hücreler, kanda fazla olan hidrojen iyonlarını (H+) idrarla atmak için tübül lümenine salgılar(sekresyon) . Bu süreç, vücuttaki asit yükünü azaltarak kan pH'sını korur.
- Amonyak ve Fosfat Tampon Sistemi: Hidrojen iyonları, idrarla atılmadan önce amonyak ve fosfat tampon sistemleri tarafından nötralize edilir. Amonyak ve fosfat, hidrojen iyonlarını tamponlayarak idrarın asiditesini kontrol eder. Tübüler lümene salgılanan bir hidrojen iyonu (H+), bikarbonat (HCO3-) dışında bir tamponla birleştiğinde net etki, kana yeni bir bikarbonatın (HCO3-) eklenmesidir. Bu süreç, böbrekler ekstrasellüler sıvıdaki bikarbonatı depolarını tekrar doldurabilir.
Şimdi bunu detaylandıralım.
1. Bikarbonatın Reabsorbsiyonu (Geri Emilimi)
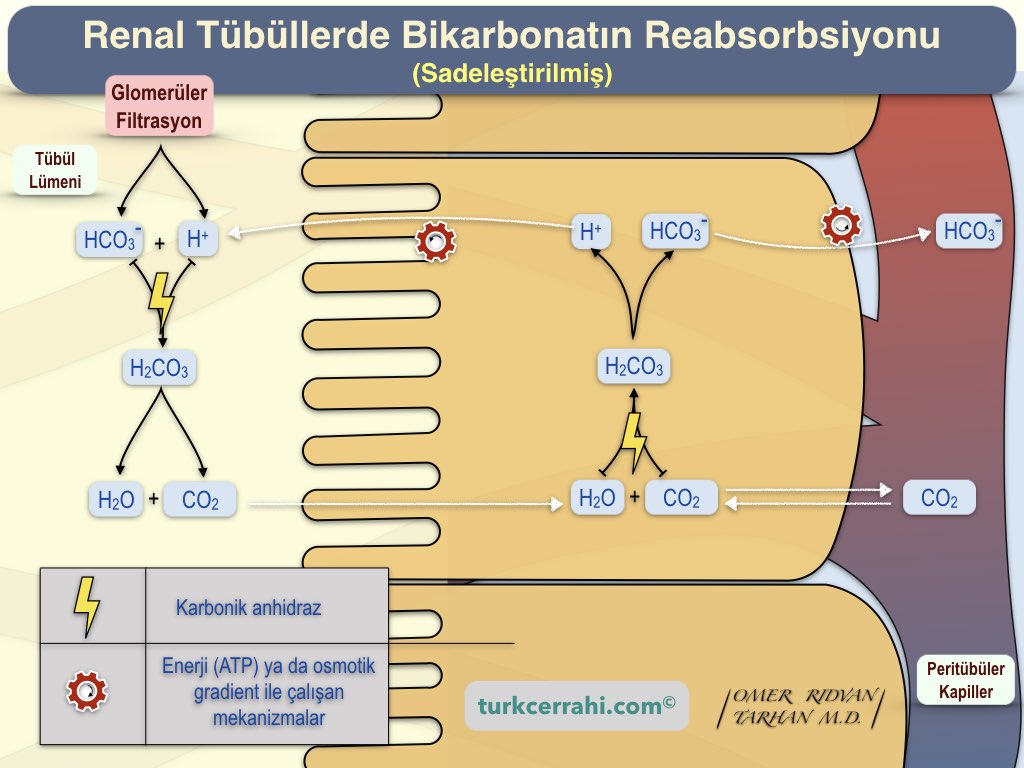
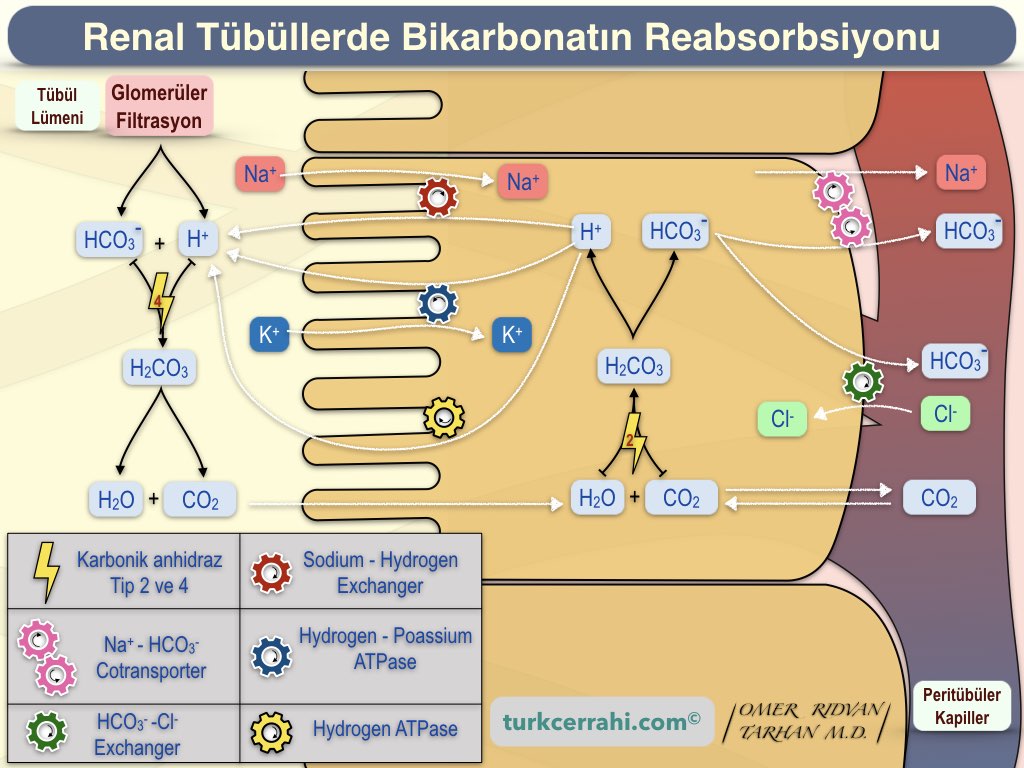
İyonların hücre zarından difüzyonla geçemediğini birkaç kez söylemiştik o zaman bikarbonat nasıl geri emilir?
Bikarbonat, tübüler hücrelerin apikal tarafından tübül lümenine sekrete edilen hidrojen iyonuyla birleşir ve karbonik asite dönüşür. Karbonik asit tübül lümeninde bulunan karbonik anhidraz (tip 4) enzimi ile su ve karbondioksite dönüştürülür. Voilà ! Karbondioksit ve su difüzyonla tübül hücresine girer ve sonra yeniden karbonik asit sentezlenir (Karbonik anhidraz tip 2). Karbonik asit de bikarbonat ve hidrojen iyonuna ayrışır. Hidrojen bu döngüye devam eder. Bikarbonat hücrenin bazolateral tarafından (tübül dışı taraf) kana karışır (Na+ - HCO3- cotransporter veya anion exchanger 1 (chloride shift) ile) . Böylece filtrattaki bikarbonatın %99.9’u kana geri geçer.
2. Hidrojen İyonu Sekresyonu
Hidrojen iyonu idrara iki türlü sekrete edilir (4. kez hatırlayalım, iyonlar hücre zarından difüzyonla geçemez).
- Sodyum-hidrojen countertransport
- Aktif transport (Hidrojen-transporting ATPaz ve hidrojen-potasyum-ATPaz)
3. Tübüldeki Fazla Hidrojen İyonunun (H⁺) Fosfat ve Amonyak Tamponları ile Birleşmesi ve Yeni Bikarbonat (HCO₃⁻) Oluşumu
Nasıl kanın normal bir pH değeri varsa, idrarın da pH'sının normal aralıkta (4.6 - 8.0) tutulması gerekir. İdrara sekrete edilen hidrojen iyonları tamponlanarak, idrarda daha fazla hidrojen iyonunun tutulabilir. Böylece hem idrar pH'sının düşmesi engellenir hem de, bu esnada yeni bikarbonat oluşturulmuş olur. İdrarda pH yı normal değerde tutmaya yardımcı olan başlıca iki kimyasal tampon sistemi bulunur.
- Amonyak tampon sistemi (daha önemli)
- Fosfat tampon sistemi
İdrarda Amonyak Tampon Sistemi
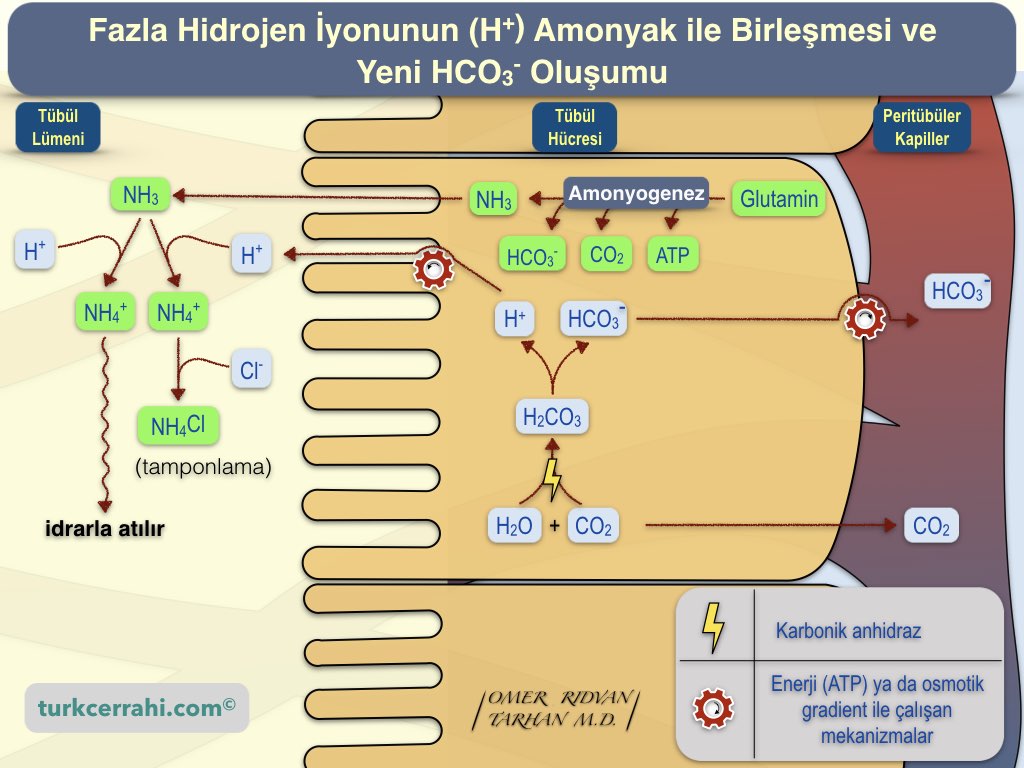
Proximal tübül hücreleri amino asitleri özellikle glutamini parçalar ve bu süreçte amonyak (NH3) oluşur. Bu olaya amonyagenez ( ammoniagenesis) denir. Amoniagenezis sürecinde her glutaminin metabolizması sonucu iki yeni amonyak (NH3) ile iki yeni bikarbonat (HCO3-) üretilir ve bir miktar enerji (ATP) ile CO2 de açığa çıkar.
Polar bir molekül olmasına rağmen, amonyak küçük boyutu nedeniyle fosfolipit çift tabakasından oluşan hücre zarından kolayca geçebilir. Böylece amonyak tübül hücresi membranından geçerek, tübül lümenine difüze olur. Lümende amonyak bir hidrojen iyonu (H+) ile birleşerek amonyum iyonunu (NH4+) oluşturur. Amonyum iyonu (NH4+), idrarda bulunan klorür (Cl⁻) ile birleşir ve amonyum klorür (NH4Cl) oluşturur. Amonyum klorür zayıf asit olduğu için tampon görevi görür. Serbest amonyum iyonunun büyük bir kısmı idrarla kaybedilir, bu da böbreklerin büyük bir miktarda hidrojen iyonundan kurtulmasını sağlar.
İdrarda Fosfat Tampon Sistemi
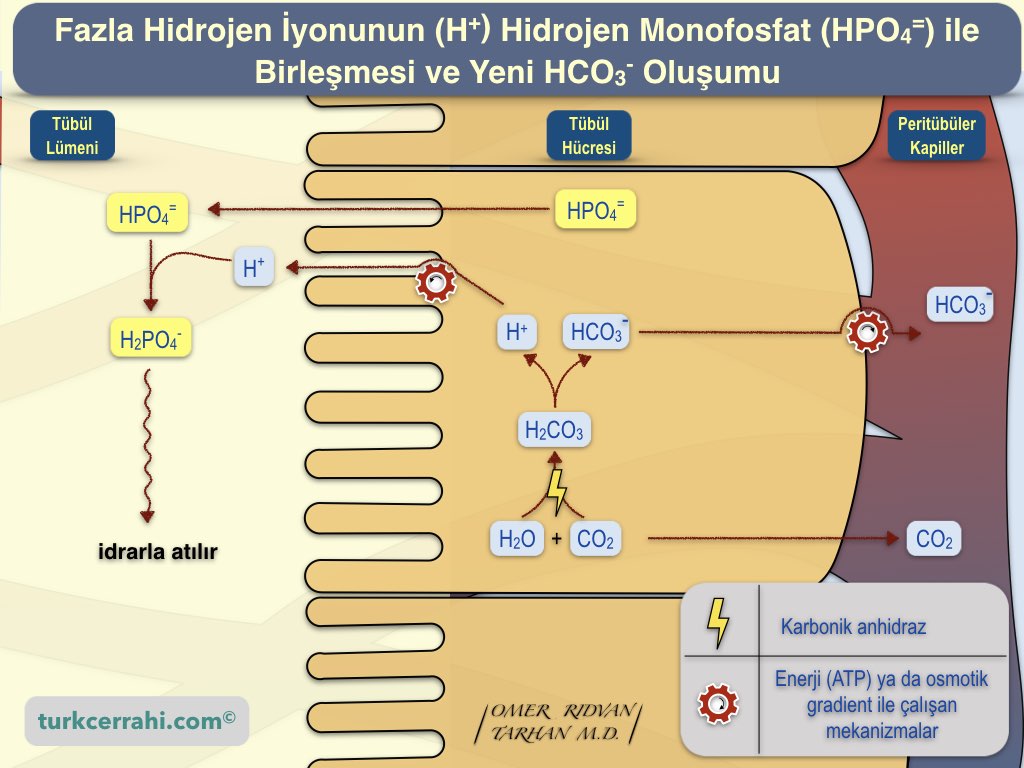
Hem dihidrojen fosfat hem de monohidrojen fosfat doğal sistemlerde yaygın olarak bulunur ve biyolojik süreçlerde kritik işlevlere sahiptir. Fosfat, ATP (adenozin trifosfat) gibi enerji taşıyan moleküllerin ve DNA, RNA gibi nükleik asitlerin yapısında bulunur. Hücre içi ve hücre dışı sıvılarda fosfat tampon sistemi, hücresel aktivitelerin düzenlenmesinde önemli bir rol oynar.
İdrar pH'ı genellikle 4.5 ile 8.0 arasında değişebilir, ancak normalde hafif asidiktir ve genellikle 5.5-6.5 aralığındadır. İdrar pH'ı fosfat tampon sisteminin pKa'sına (6,8) yakın olduğu için fosfat tampon sistemi idrarda iyi çalışır.
Monohidrojen fosfat (HPO₄=), plazmadan tübüle girer. Tübüllerden geri emilimi azdır, bu nedenle tübüllerde yoğunlaşır. Monohidrojen fosfat (HPO₄=), hidrojen iyonları (H+) ile birleşerek dihidrojen fosfat (H₂PO₄⁻) oluşturur (tamponlama) ve bu da idrarla atılır.
7. Kaynaklar
- Transport of Oxygen and Carbon Dioxide in Blood and Tissue Fluids Guyton and Hall. 14 baskı. Sayfa 528-529
- Electron Pathways through Erythrocyte Plasma Membrane in Human Physiology and Pathology: Potential Redox Biomarker? Matteucci E, Giampietro O. February 2007. Biomarker Insights. 2:321-9
- Transport of Oxygen and Carbon Dioxide in Blood and Tissue Fluids Guyton and Hall. 14 baskı. Sayfa 524
- Transport of Oxygen in the Blood. The respiratory System. Lumenlearning.com.
- Acid-Base Regulation. Guyton and Hall. 14 baskı. Sayfa 407-408
- Arterial Chemoreceptors and Sympathetic Nerve Activity: Implications for. Hypertension and Heart Failure. Harold D. Schultz, Yu L. Li, and Yanfeng Din. Hypertension. Volume 50, Number 1.
- Respiration: control of ventilation. Craig Lyons, Leo G Kevin. Anaesthesia & Intensive Care Medicine. 25:2. 112-116.
- Acid-Base Balance. Anatomy and Physiology (openstax PDF) Sayfa: 1266-1267